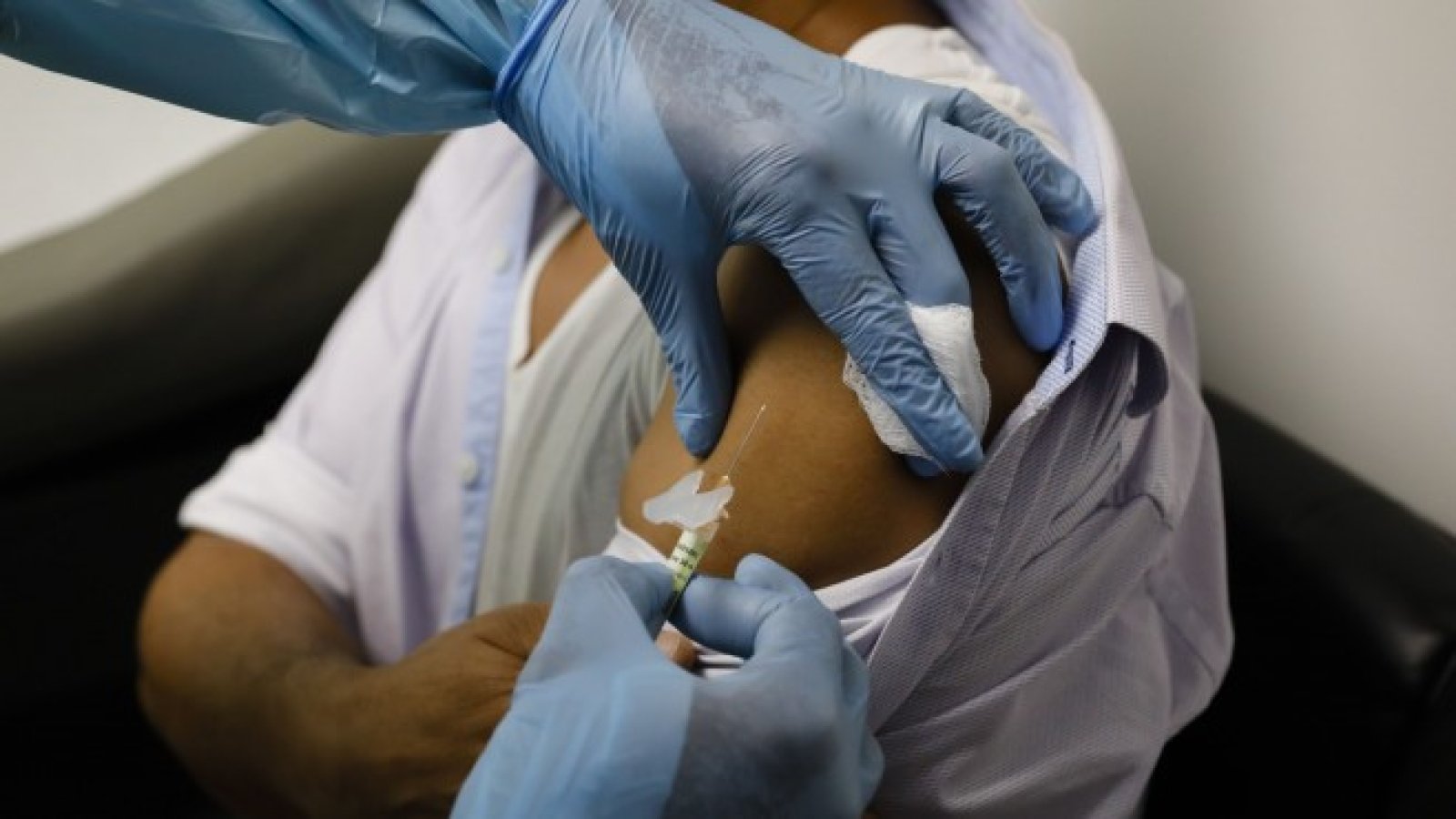
В рамките на надпреварата за първата в света одобрена ваксина срещу коронавируса германският концерн BioNTech и партньорът Pfizer постигнаха значителен, ако не и решаващ напредък. Базираната в Майнц биотехнологична компания и американският фармацевтичен концерн обявиха първите данни от клиничното проучване от фаза 3, свързано с одобрението, за техния кандидат за ваксина BNT162b2, което се очакваше от дни.
Според двете компании потенциалната ваксина е постигнала ефективност от над 90 процента седем дни след втората доза. Това означава, че се постига защита 28 дни след началото на ваксинацията, се казва в съобщението.
Ваксинацията се състои от две дози по 30 микрограма всяка. Данните се базират на 94 оценени случая на тестови субекти, получили ваксината или пласебо. Компаниите все още не са предоставили информация за това колко дълго може да продължи защитният ефект, предава DPA.
Съобщението дава най-ясното доказателство досега, че учените напредват в разработването на ваксина, която може да сложи край на пандемията. Инвеститорите отговориха, като натрупаха рискови активи и разпродадоха активите убежища.
Фючърсите върху S&P 500 скочиха с 3,6%, а тези върху Russell 2000 за акциите с малка капитализация нараснаха със 7%. Технологичният индекс Nasdaq 100 отбеляза слаб ръст, но все пак нарасна с 0,8%.
Предварителните резултати за ваксината проправят пътя на компаниите да търсят разрешение за спешна употреба от регулаторите, ако по-нататъшните изследвания покажат, че ваксината е безопасна.
Акциите на Pfizer удължиха печалбите си от предборсовата сесия, поскъпвайки с около 7%. Цената на американските депозитарни разписки за BioNTech, която също разработва ваксината, се е увеличила с около 11%.
Първият предварителен анализ на ефективността е извършен на 8 ноември от външна, независима комисия. Не са отчетени сериозни опасения за безопасността. BioNTech и Pfizer също така са събрали данни за безопасността и поносимостта и в предишни клинични тестове.
mRNA ваксина засега не е одобрявана
Сега BioNTech и Pfizer искат да кандидатстват пред Американската агенция по лекарствата (FDA) за спешно одобрение, като в момента се предполага, че това може да стане до третата седмица на ноември. Времевият диапазон се определя от допълнителните необходими данни, свързани с периода на наблюдение след ваксинацията.
Партньорите водят преговори и с други регулаторни органи. Европейската агенция по лекарствата (EMA) също оценява ваксината в продължение на няколко седмици в ускорен, така наречен процес на непрекъснат преглед, при който данните се предоставят непрекъснато, вместо едва в края на клиничните проучвания. И в Европа надеждите на политиците почиват, наред с другото, върху ваксината от Майнц.
BioNTech и Pfizer разчитат на mRNA ваксинация (матрична РНК), която използва веществата, отговорни за комуникацията между клетките. Базираната в Тюбинген биотехнологична компания Curevac и американската компания Moderna, която също е напреднала в развойната дейност, също разчитат на тази технология. Все пак обаче досега такава ваксина никога не е била одобрявана.
Първоначално BioNTech и Pfizer искаха да представят първи междинен доклад след 32 случая, но в консултация с американската FDA те се насочиха към минимум 62 случая. В края на разговорите с органа обаче вече е имало 94 случая. Такива междинни анализи са често срещани при мащабните проучвания. По-конкретно, след определен брой тестови субекти, заразени с вируса, се премахва така нареченото заслепяване на данните, т.е. конфиденциалността на разпределението на групата и се проверява колко от заразените субекти са получили преди това плацебо и колко са получили кандидата за ваксината.
Затова за фармацевтичните производители е важно къде се извършват големите проучвания. Британско-шведската фармацевтична компания Astra-Zeneca, която също работи върху ваксина в третата фаза на изследванията заедно с Оксфордския университет, обяви преди няколко дни, че евентуалните доставки на собствената ѝ ваксина ще бъдат забавени, тъй като все още чака данни за ефикасност. Данните от проучването бяха забавени, тъй като броят на инфекциите в Обединеното кралство намаля през лятото. В резултат на това имало твърде малко заразени хора, които могат да заразят други, за да се провери ефективността на ваксините, се казва в съобщението.
Предисторията
BioNTech и Pfizer започнаха последното си клинично изпитване от фаза 3 в края на юли, само дни след конкурента Moderna. По това време около 30 000 доброволци на възраст между 18 и 85 години трябваше да бъдат ваксинирани с две дози от по 30 микрограма всяка в 120 учебни центъра по целия свят, започвайки от Америка. През септември бе обявено, че компаниите планират да включат до 44 000 субекта, за да се включат и по-млади хора на възраст 16 и повече години, както и хора с предшестващи състояния като ХИВ, хепатит С или В.

Към този момент в проучването са участвали 43 538 субекта, от които почти 39 000 вече са получили втората доза. Около 42% от глобалните и 30% от американските участници са имали етнически разнообразен произход. Проучването продължава и ще наблюдава обектите в продължение на две години.
Вместо целевите до 100 милиона дози обаче тази година трябва да бъдат предоставени само до 50 милиона дози, се казва в съобщението, без да се посочва причината. За следващата година все още се планират до 1,3 милиарда дози. За тази цел Biontech и Pfizer разшириха производствения си капацитет през последните месеци. Въпреки това различни правителства вече са осигурили стотици милиони дози предварително.








 Европа е готова да използва всички търговски инструменти за защита срещу Китай
Европа е готова да използва всички търговски инструменти за защита срещу Китай  Антикорупционната кампания превръща Виетнам в още една китайска провинция
Антикорупционната кампания превръща Виетнам в още една китайска провинция  Военната мобилизация на Русия застрашава ключовата петролна и газова индустрия
Военната мобилизация на Русия застрашава ключовата петролна и газова индустрия  Четиридневната работна седмица ще е стандарт, но след десетилетия
Четиридневната работна седмица ще е стандарт, но след десетилетия  Самърс: Дезинфлацията не е поставена на сигурна основа
Самърс: Дезинфлацията не е поставена на сигурна основа 
 Израел нападна Рафах след обявеното от "Хамас" примирие
Израел нападна Рафах след обявеното от "Хамас" примирие  Един загинал и 47 затрупани при срутване на сграда в Африка
Един загинал и 47 затрупани при срутване на сграда в Африка  Ботев (Пд) и ЦСКА 1948 не успяха да си отбележат в сблъсък за седмото място
Ботев (Пд) и ЦСКА 1948 не успяха да си отбележат в сблъсък за седмото място  Дейвид Мойс си тръгва от "Уест Хем"
Дейвид Мойс си тръгва от "Уест Хем"  "Аталанта" срази "Салернитана" и измести "Рома" от петото място
"Аталанта" срази "Салернитана" и измести "Рома" от петото място 
 Кайрън Уилсън е новият световен шампион по снукър
Кайрън Уилсън е новият световен шампион по снукър  Палас разфасова Ман Юнайтед на Гергьовден
Палас разфасова Ман Юнайтед на Гергьовден  Остава ли Николай Костов? Левски обяви важна новина
Остава ли Николай Костов? Левски обяви важна новина  Непослушен и чуплив: Каранга бяга от ЦСКА
Непослушен и чуплив: Каранга бяга от ЦСКА 
 продава, Тристаен апартамент, 89 m2 София, Студентски Град, 177000 EUR
продава, Тристаен апартамент, 89 m2 София, Студентски Град, 177000 EUR  продава, Къща, 210 m2 София, Доброславци (с.), 450000 EUR
продава, Къща, 210 m2 София, Доброславци (с.), 450000 EUR  продава, Парцел, 30 m2 Варна област, гр. Провадия, 76726.34 EUR
продава, Парцел, 30 m2 Варна област, гр. Провадия, 76726.34 EUR  продава, Парцел, 507 m2 Добрич област, к.к.Албена, 0 EUR
продава, Парцел, 507 m2 Добрич област, к.к.Албена, 0 EUR  продава, Двустаен апартамент, 68 m2 Варна, Владиславово, 75000 EUR
продава, Двустаен апартамент, 68 m2 Варна, Владиславово, 75000 EUR 
 Защо Ким Кардашиян и футболистът са се разделили?
Защо Ким Кардашиян и футболистът са се разделили?  Емили Ратайковски се показа топлес в банята
Емили Ратайковски се показа топлес в банята  Седем защитни камъка срещу негативна енергия
Седем защитни камъка срещу негативна енергия  Китай е поел ангажимент да не продава оръжия на Русия
Китай е поел ангажимент да не продава оръжия на Русия  Ботев и ЦСКА 1948 с реми в битката за седмото място
Ботев и ЦСКА 1948 с реми в битката за седмото място 






